미라셀 신의료기술 통과…줄기세포, 개원가 먹거리 될까
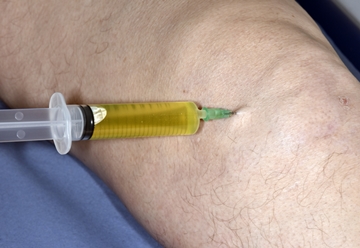
메디칼타임즈=김승직 기자미라셀의 '무릎 골관절염 환자에서의 골수 흡인 농축물 관절강내 주사'가 보건복지부 신의료기술 평가를 통과하면서, 줄기세포 치료가 다시 정형외과 먹거리가 될 수 있을지 귀추가 주목된다.앞서 미라셀은 자사 줄기세포 추출시스템인 스마트엠셀과 전용키트를 이용한 골관절염 골수줄기세포 치료술로 지난해 11월 신의료기술을 등재 신청한 바 있다.이어 지난 5월 신의료기술평가위원회 심의 결과, 무릎관절 통증 완화와 기능 개선에서 안전성·유효성을 인정받아 지난 11일 고시 발령이 공지됐다. 미라셀은 2012년에도 연골결손 환자에 대한 자가골수 줄기세포 이식술(BMAC)로 유일하게 신의료기술을 획득한 바 있다.김완호정형외과의원 김완호 원장은 인터뷰서, 이번 신의료기술 등재로 줄기세포 치료가 보다 활성화될 것이라고 기대했다.이때 신의료기술 신청에 함께했던 김완호정형외과의원 김완호 원장은 지난 25일 보건의료전문지 기자들과의 인터뷰에서, 이번 신의료기술로 줄기세포 치료가 보다 활성화될 것이라고 기대했다.우리나라에서 줄기세포를 이용한 관절염 치료는 BMAC으로 이름을 알리기 시작했다. 이 치료법은 관절 연골 결손 환자의 골수에서 혈액을 채취해 줄기세포만 분리한 후, 다시 손상된 관절 연골 부위에 이식하는 치료법이다. 이렇게 주입된 줄기세포가 손상된 연골 조직을 재생해 자가 치유하는 식이다.하지만 이 기술은 이식술의 한계로 외상 등으로 2~10cm²의 연골손상이 생긴 15세 이상, 50세 이하의 환자에게만 적용할 수 있어 보편화되지 않았다.이어 연령 제한이 없는 주사방식인 카티스템이 등장하면서 줄기세포 관절염 치료에 대한 관심도가 높아졌다. 하지만 이는 우리나라에서만 허가되는 등 안정성 면에서 이견이 있어왔다.더욱이 2019년 퇴행성관절염 유전자치료제인 인보사케이주가 성분 조작 의혹에 휩싸이면서 관련 치료에 대한 국민 관심이 멀어진 상황이다.개원가는 이번 신의료기술 등재를 이 같은 국민 관심을 되돌릴 수 있는 기회로 받아들이는 모습이다. 특히 김 원장은 BMAC은 10년 전 국내에 도입된 이후 현재도 수술에 이용되고 있을 정도로 결과가 좋은 치료법이라고 강조했다.특히 이번 신의료기술은 관절경 등 수술적 방법을 통하지 않고 직접 주사로 이식하는 방법으로, 전신마취 위험성이나 수술에 의한 부작용 없이 치료가 가능하다는 설명이다.이는 일반적인 무릎 퇴행성관절염 환자는 물론 비교적 젊은 나이의 연골 결손 환자에게도 유용한 치료라는 것.이와 관련 김 원장은 "줄기세포 치료법이 세계적으로 세 가지 방법으로 발전하고 있으며 적응증에 대한 정립과 치료 후 관리 방법도 고도화되고 있다"며 "배양 없이 자가 줄기세포를 이용하거나 자가 줄기세포를 배양해 이용하는 방식, 또 이종 줄기세포를 배양해 치료하는 방법이다"라고 말했다.이어 "이번에 통과된 기술은 자가 줄기세포 배양 없이 이뤄지는 치료법으로 배양하는 방법 보다 시간·안정성 면에서 뛰어나다고 볼 수 있다"고 강조했다. 골수 흡인 농축물 관절강내 주사가 신의료기술로 등재되면서, 관절염 줄기세포 치료가 다시 의료계 관심을 끌 수 있을지 귀추가 주목된다.다만 이 기술이 히알루론산 관절강내 주사 등 기존 치료와 유사한 효과를 가지고 있다는 것에는 물음표가 찍힌다. 실제 신의료기술 평가를 보면 이는 기존 주사치료와 유사한 수준의 통증 완화, 관절 기능 개선 효과를 보이고 있다고 언급되고 있다.표면적으로 봤을 때 굳이 이 기술로 관절염을 치료해야 할 요인이 적다는 뜻이다. 이와 관련 김 원장은 이 기술은 기존 치료와 달리 정기적 치료 없이 1회 시술로도 효과를 볼 수 있다고 강조했다.이번 신의료기술이 환자의 연골을 직접 재생시키는 유일한 방법이라는 설명이다. 이 기술이 기존 관절강내 주사와 같은 선상에 놓인 것은 평가에서 비교군을 두기 위함으로, 이와 동등성·안전성 평가를 받은 것은 오히려 플러스 요인이라는 것.이와 관련 김 원장은 "골수 흡인 농축물 관절강내 주사치료법은 무릎 퇴행성관절염에 대한 1차 치료제가 아니다"라며 "기존 주사제 치료로 효과를 보지 못한 환자들이 선택적으로 치료 시 효과를 볼 수 있는 기술"이라고 강조했다.BMAC이 국내에 처음 소개한 이후 10년이 넘는 기간 동안 임상 데이터가 쌓여 효과와 안정성이 검증됐다는 언급도 있었다. BMAC과 이번 신의료기술은 이식인지, 주사인지 등 방법의 차이만 있기 때문이다. 이식술로 통과된 BMAC이 현재도 사용되는 만큼, 이번에 통과된 주사방식으로 연령제한이 사라져 활용도가 올라갈 것이라는 기대다.다만 김 원장은 이 기술이 골수 채취하는 의사에 따라 결과가 달라질 수 있다는 것을 난점으로 꼽았다. 일반적으로 이 같은 기술은 학회 등을 통해 질 관리가 이뤄지는데, 아직 이슈화가 덜 돼 관련 논의가 이뤄지지 않고 있다는 설명이다.이와 관련 그는 "줄기세포 치료가 모든 무릎 관절염 치료를 완벽하게 치료할 수는 없다. 초기부터 병원에서 주기적인 치료 및 관리를 받으며 적당한 운동을 해야 한다"며 "다만 경험상 BMAC을 받은 환자는 1회만으로도 1년 동안 점진적으로 증상이 좋아졌다. 초창기 환자들이 10년이 지난 지금도 문제가 없다. 지금은 줄기세포 치료에 관심이 시들해져 다시 이슈화되려면 시간이 필요할 것 같다"고 말했다.